作者:张维燕
近日,我校日本av女优
、生物反应器工程全国重点实验室张立新团队刘雪婷课题组在真菌双功能萜合酶的“定制化”改造研究中取得突破性进展。研究成果以“G2 helix as the plastic region modulating diastereoselectivity of cyclization in fungal bifunctional sesterterpene synthases”为题,发表于国际知名催化领域期刊ACS Catalysis上。
萜类化合物是自然界中极其重要的一类“天然小分子”,许多著名药物如青蒿素、紫杉醇都属于萜类。真菌中的双功能二倍半萜合酶(BF-STPSs)能够把结构简单的原料组装成骨架复杂、活性独特的萜类分子。然而,科学家们对这类酶是如何精准“折叠”和“组装”这些分子的机制了解不多,这限制了我们通过人工改造来“定制”新型药物分子的能力。
研究团队通过蛋白质工程与计算化学模拟相结合,首次揭示了一个关键的“调控按钮”—G2螺旋。研究发现,G2螺旋像一个“操控杆”,能调整中间体分子的构象和环化路径,决定最终生成的萜类分子B环形成的立体构型并改变它的骨架结构。通过改造DpPS和FoFS两种真菌萜合酶的G2螺旋,研究团队成功合成出一系列此前未见的新型二倍半萜分子。其中,FoFS-V195A能够一次性“拼装”出五种不同骨架的分子,而DpPS-V194A则实现了从双环结构到三环结构的“跨越式”变化。计算模拟(包括DFT和分子动力学)进一步证实,G2螺旋的变化能够“引导”中间体的构象多样性,从而产生更多样化的分子骨架和立体结构。这一研究不仅为深入理解真菌萜合酶的工作机制提供了新思路,还为未来通过“精准设计”创造新型药物分子奠定了重要基础。
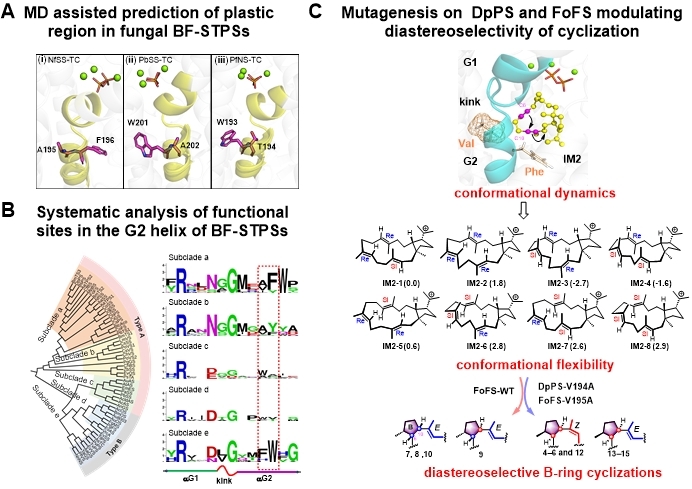
图片说明:(A)分子动力学模拟辅助预测萜类环系演化的可塑区;(B)系统分析双功能萜合酶G2-helix的功能氨基酸位点;(C)调控DpPS和FoFS催化环化反应的对映选择性。
我校刘雪婷教授和中山大学巫瑞波教授为该论文的共同通讯作者,我校博士后张维燕和中山大学博士生徐康为是该论文的共同第一作者。该研究工作得到了国家自然科学基金、上海感染与免疫科技创新中心和国家重点研发计划等资金支持。
原文链接://pubs.acs.org/doi/abs/10.1021/acscatal.5c03947